Resolução:
Q = m . c . variação da temperatura
3000 = 150 . c . 20
c = 1 cal/g . °C
Obs: Pelo fato de o calor específico ter dado 1cal/g . °C, podemos concluir q essa substância é a água.
2. Quantas calorias são necessárias para se aquecer 200 l de água, de 15 °C a 70 °C?
Resolução:
Q = m . c . variação da temperatura
Q = 200 . 1 . (70 – 15)
Q = 11000 cal
3. Determine:
a) o calor específico do material
b) a capacidade térmica da substância
Resolução/ São dados do exercício:
m = 1kg = 1000 g
Q = + 400 cal
t0 = 10 0C
tf = 60 0C.
a) – A variação de temperatura da substância é dada por:
∆t = tf – t0
∆t = 60 – 10
∆t = 50 0C
- Pela equação da quantidade de calor obtemos o calor específico da substância:
Q = m.c.∆t
400 = 1000 . c . 50
400 = 50 000 . c
400 / 50 000 = c
c = 0,008 (cal / g . 0C )
b) – A capacidade térmica é obtida pela equação C = m.c, logo:
C = m.c
C = 1000 . 0,008
C = 8 cal/0C
Respostas :
a) c = 0,008 (cal / g . 0C )
b) C = 8 cal/0C
Calor
(1) Para derreter uma barra de um material w
de 1kg é necessário aquecê-lo até a temperatura de 1000°C. Sendo a
temperatura do ambiente no momento analisado 20°C e o calor específico
de w=4,3J/kg.°C, qual a quantidade de calor necessária para derreter a barra?
(2) Um bloco de ferro de 10cm³ é resfriado de 300°C para 0°C. Quantas calorias o bloco perde para o ambiente?
Dados: densidade do ferro=7,85g/cm³ e calor específico do ferro=0,11cal/g.°C
O primeiro passo é descobrir a massa do
bloco, sabendo sua densidade e seu volume (é importante prestar bastante
atenção nas unidades de cada grandeza).
Conhecendo a massa, podemos calcular a quantidade de calor do corpo:
Como Q<0, a transferência de calor acontece no sentido do bloco para o meio ambiente (libera calor).
(3) Qual a quantidade de calor absorvida para que 1L d'água congelado e à -20°C vaporize e chegue a temperatura de 130°C.
Dados:
Calor latente de fusão da água: L=80cal/g
Calor latente de vaporização da água: L=540cal/g
Calor específico do gelo: c=0,5cal/g.°C
Calor específico da água: c=1cal/g.°C
Calor específico da água: c=0,48cal/g.°C
Densidade da água: d:1g/cm³
1L=1dm³=1000cm³
m=d.V
m=1000g
Trocas de calor
(1) Um bloco de uma material desconhecido e de massa 1kg
encontra-se à temperatura de 80°C, ao ser encostado em outro bloco do
mesmo material, de massa 500g e que está em temperatura ambiente (20°C).
Qual a temperatura que os dois alcançam em contato? Considere que os
blocos estejam em um calorímetro.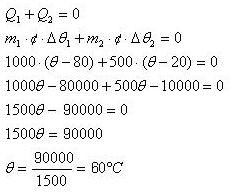
(2) Em uma cozinha, uma chaleira com 1L de água
ferve. Para que ela pare, são adicionados 500mL de água à 10°C. Qual a
temperatura do equilíbrio do sistema?
Qualquer quantidade de água que esteja
fervendo encontra-se à temperatura de 100°C, se a temperatura for
superior a esta, não haverá água líquida, apenas vapor.
FICOU BEM ESTENSO MAIS BREVEMENTE ESTAREI POSTANDO MAIS QUE SEJAM RELEVANTES DUVIDAS COPIE E LEVE AO PROFESSOR ELE TE GUIARA DA FORMA CORRETA
CREDITOS AO GOOGLE
Nenhum comentário:
Postar um comentário